基于可转化的材料组分和巧妙的设计思想,创建智能递送系统,是提高已批准药物疗效的重要策略。近日,中国科学院化学工程学院岗位教师魏炜研究员团队与北京朝阳医院、澳大利亚昆士兰大学合作,基于调节性T细胞(Treg)来源的外泌体巧妙负载了血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)抗体,通过新的递送模式以及新的拮抗机制,显著抑制了眼底新生血管性疾病的进展。相关工作发表于Nature Biomedical Engineering上(Reduction of choroidal neovascularization via cleavable VEGF antibodies conjugated to exosomes derived from regulatory T cells,DOI: https://doi.org/10.1038/s41551-021-00764-3)。
眼底新生血管的形成是年龄相关性黄斑变性、糖尿病视网膜病变等多种眼底疾病发生过程中的重要环节,若得不到有效治疗将严重影响生活及工作,甚至导致视力的丧失。临床现有的主要治疗方法是玻璃体腔内注射VEGF抗体,以此抑制新生血管的生长,但仍然存在药物随房水代谢过快、难以富集眼底病灶和单一治疗策略效果有限的难题。因此,即便多次注射,临床实际响应率也仅为40-60%。
为此,研究团队基于体内Treg来源的外泌体(rEXS)和临床现有的VEGF抗体药物,提出了“时空耦合”递送和“抗VEGF-抗炎”协同治疗的新策略,并联合北京朝阳医院和昆士兰大学交叉合作,进行了新型眼底新生血管性疾病治疗药物的研发。
研究团队首先基于大量临床眼内液样本,发现眼底新生血管性疾病不仅含有高水平的VEGF,而且富集了IL-6、TNF等大量的炎症因子,并且相互之间具有明显的正相关性,揭示了眼底新生血管发生发展过程中血管新生和炎症之间的紧密互作关系,并以此提出了抗VEGF-抗炎的协同治疗新思路。
在此基础上,研究团队利用体内具有天然抗炎活性的rEXS为载体,通过基质金属蛋白酶(MMP)敏感肽段(cL)连接VEGF抗体(aV),创建了rEXS-cL-aV体系。当玻璃体腔注射后,利用rEXS向炎症部位的趋化性,携带aV富集于眼底新生血管病灶,随后利用病灶部位高表达的MMP酶解敏感肽段cL并释放aV。在上述时空耦合递送的基础上,分别利用rEXS的抑制炎症作用和aV的抑制血管生成作用实现协同增效。研究人员在小鼠和食蟹猴的脉络膜新生血管(CNV)动物模型中证明,单次注射rEXS-cL-aV即可显著抑制新生血管性疾病的发生和发展,效果显著优于现有的单独VEGF抗体治疗策略。
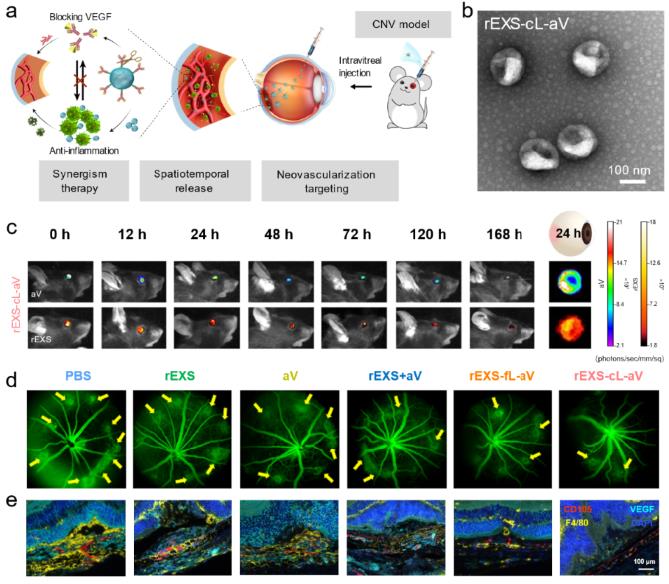
图1 调节性T细胞外泌体递送VEGF抗体用于小鼠CNV的治疗:a. rEXS-cL-aV构建、时空耦合递送和抗VEGF-抗炎协同治疗的示意图;b. rEXS-cL-aV透射电镜图;c.rEXS-cL-aV延长在小鼠眼内滞留时间及增强眼底CNV部位富集;d.小鼠CNV病灶基底荧光血管造影分析;e.脉络膜组织切片中血管内皮细胞(CD105)、巨噬细胞(F4/80)、VEGF的分析
据研究人员介绍,上述成果仍属于动物水平的临床前研究,实际临床疗效仍有待进一步验证。鉴于自体细胞组分和已批准抗体的安全性、治疗结果的有效性和重现性,该制剂具有较好临床转化潜力。研究团队正在按照相关要求合作推进临床个体化治疗的研究。
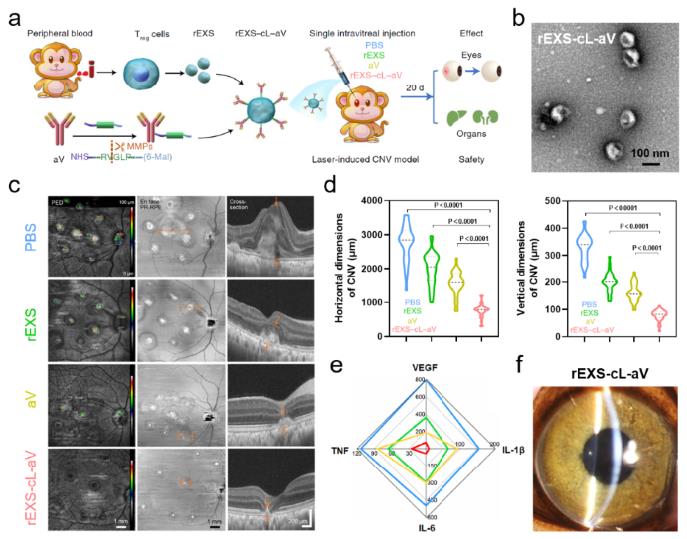
图2 rEXS-cL-aV治疗食蟹猴CNV模型的疗效:a. rEXS-cL-aV的构建及在食蟹猴CNV模型中治疗策略示意图;b. rEXS-cL-aV透射电镜图; c. 光学相干断层扫描血管成像分析rEXS-cL-aV在食蟹猴CNV模型中治疗效果;d. 定量分析图c中病灶的水平垂直范围;e. 食蟹猴各组给药后眼内房水中VEGF,IL-6,IL-1β及TNF含量;f. 玻璃体腔注射rEXS-cL-aV后裂隙灯观察眼前节情况
近五年来,该团队中魏炜研究员提出了仿生剂型工程的新策略,基于蛋白、细菌、细胞等体内组分发现和创制了一系列仿生递送新剂型,借助固有的天然路径实现体内的精准递送,在动物模型上成功用于靶向治疗、免疫治疗和个体化治疗,并且部分剂型已通过医院伦理批准进入个体化临床前和临床研究。相关工作相继发表于Nat Biomed Eng2021, 5, 414、Sci Adv 2021, 7, eabd7614、Sci Adv 2021, 7, eaba2458、Sci Adv 2020, 6, eaay7735、Sci Adv 2019, 5, eaaw3192、Nat Commun 2017, 8, 14537、Nat Commun 2019, 10, 5165、Adv Mater 2020, 32, 2002085、Adv Mater2020, 32, 2002940、Adv Sci2020, 7, 2001108等期刊上。
田颖博士及张帆博士为该论文共同第一作者,魏炜研究员(过程工程研究所)、陶勇教授(北京朝阳医院)和余迪教授(昆士兰大学)为共同通讯作者。该工作得到了国家自然科学基金、北京市教委科技计划项目和北京朝阳医院人才培养计划项目的支持。